现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质中属于电解质有: (用物质序号填空),
可以利用⑦具有 现象这一简单物理方法区分⑦、⑧二种分散系。
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
少量的④通入⑥的溶液中反应的离子方程式为 。
(3)17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为 ,
SO42-的物质的量浓度为 。
(4)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
写出该反应的离子方程式并标出电子转移方向和数目:
当有4.48升(标况)NO气体产生时,转移电子的物质的量为 ,被还原HNO3的质量为 克。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空: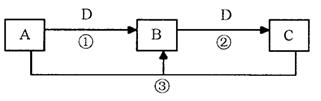
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是(只写一种)。
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为。
(3)若D的氯碱工业的主要产品,B有两性,则反应②的离子方程式是。
(4)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为。
向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g)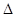 H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCL3)/mol |
0 |
0.16 |
0.19 |
0.2 |
0.2 |
回答下列问题
(1)反应在前50 s的平均速率v(PCI5)=________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有________。
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4),该反应的化学方程式是________。
若将0.01 mol PCI5投入l L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________ [已知Ksp(Ag3 PO4)="1.4" x 1 0-16,Ksp(AgCl)="1.8" x 10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为____________________________。
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出)。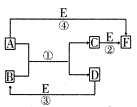
(1)若A、D、E是短周期的非金属单质,且 A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为________;F的分子构型为________;反应①的化学方程式为__________________。
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式_ _________________;足量的A与B溶液充分反应后,生成物C中金属阳离子的检验方法为__________________;若以惰性电极电解B的水溶液,当阴极增重9.6g时,阳极生成气体在标准状况下的体积为________,写出电解B的水溶液的离子方程式__________________。
已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。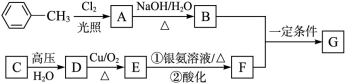
(1)G的名称为____________________。
(2)指出下列反应的反应类型:A转化为B:___________;C转化为D:__________。
(3)写出下列反应的化学方程式:
G与足量NaOH溶液反应的化学方程式:____________________________________。
(4)符合下列条件的G的同分异构体数目为________种:
①苯环上有3个取代基,且有两个取代基相同;②能够与新制的银氨溶液反应产生光亮的银镜。
其中氢原子共有四种不同环境的所有物质的结构简式为__________、____________。
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: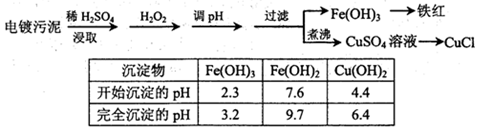
(1)酸浸后加入H2O2的目的是。调pH步骤中加入的试剂最好是(填化学式)。实验室进行过滤操作所用到的玻璃仪器有。
(2)煮沸CuSO4溶液的原因是。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式。
(3)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数。
(4)Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数表达式为。
Fe(OH)3+3H+,该反应的平衡常数表达式为。