锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3 + 3O2 + 6Fe Sb4O6 + 6FeS ②Sb4O6 + 6C
Sb4O6 + 6FeS ②Sb4O6 + 6C 4Sb + 6CO↑
4Sb + 6CO↑
关于反应①、②的说法正确的是
| A.反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| C.反应②说明高温下C的还原性比Sb强 |
| D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4∶3 |
下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是
| A.根据物质的元素组成,将纯净物分为单质和化合物 |
| B.通过镁、锌、铁分别与稀盐酸反应的实验现象,比较不同金属的活泼性强弱 |
| C.根据铁制品表面的锈可用稀盐酸溶解除去的事实,说明铁锈主要成分是酸性氧化物 |
| D.打开盛装浓盐酸的试剂瓶塞,观察现象,了解盐酸的某些物理性质 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O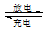 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
体积为1 L的某溶液中含有的离子如表所示:
| 离子 |
Cu2+ |
Al3+ |
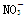 |
Cl- |
 |
1 |
1 |
a |
1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是
A.阴极析出的金属是铜与铝B.a=3
C.阳极生成1.5 mol Cl2D.电解后溶液的pH=0
已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误的是
| A.在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出 |
| B.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 |
| C.由于Ksp(AgCl)>Ksp(AgI),AgCl沉淀在一定条件下可转化为AgI沉淀 |
| D.往氯化银的悬浊液中加硝酸银固体,c(Cl—)、c(Ag+)均减小 |
下列叙述中不正确的是
| A.将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3 |
| B.溶液中c(H+)>c(OH—),该溶液一定显酸性 |
| C.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极 |
| D.外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池 |