下列各表述与示意图一致的是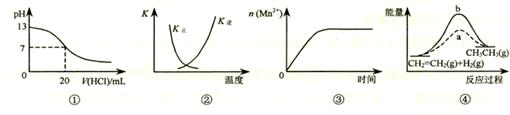
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0,正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0,正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
下列反应方程式的书写正确的是 ( )
| A.金属铁溶于盐酸中:2Fe+6H+=2Fe3++3H2↑ |
B.N2+O2 NO2 NO2 |
| C.向AlCl3溶液中加入过量NaOH溶液:AlCl3+3NaOH=Al(OH)3↓+3NaCl |
D.2Na+O2 Na2O2 Na2O2 |
下列叙述正确的是 ( )
| A.氨气遇浓盐酸产生白烟 | B.碳酸氢钠比碳酸钠稳定 |
| C.硅酸盐用于生产光导纤维 | D.硅酸盐不怕酸碱腐蚀 |
下列微粒既有氧化性又有还原性的是( )
氯气溶于水发生的反应为:Cl2+H2O=HCl+HClO下列分析正确的是 ( )
| A.氯气是氧化剂,水是还原剂 | B.水被还原,氯气被氧化 |
| C.氯气既是氧化剂,又是还原剂 | D.该反应不是氧化还原反应 |
下列各项对应的电离方程式或离子方程式书写正确的是 ( )
| A.NaHSO4熔融态的电离:NaHSO4=Na++HSO4- |
| B.NaHCO3在水中电离:NaHCO3==Na++H++CO32- |
| C.Cu(OH)2溶于硫酸溶液:H++OH-=H2O |
| D.实验室制取CO2:CO32-+2H+=CO2↑+H2O |