我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油。甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g) 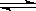 CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
请根据图示回答下列问题:
(1)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_______________。
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b。
(3)写出该反应的热化学方程式 。
(4)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(5)恒容条件下,下列措施中能使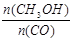 增大的有 。
增大的有 。
A.升高温度 B.充人He气
C.再充入1molCO和2molH2 D.使用催化剂
(6)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡 (填“逆向移动”、“正向移动”、“不移动”)
(7)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容器 |
甲 |
乙 |
丙 |
| 投料量 |
1mol CO 、2mol H2 |
1molCH3OH |
2molCH3OH |
| CH3OH的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
吸收Q3kJ |
| 体系压强(Pa) |
P1 |
P2 |
P3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
则下列关系正确的是
A.c1= c2 B.Q3= 2Q2 C.2 P1<P3
D.α1+α2=1 E.2α2=α3
E.2α2=α3
F.该反应若生成1molCH3OH放出的热量为(Q1+ Q2)kJ
(8)若在一体积可变的密闭容器中充入1mol CO、2mol H2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是
(1) 下列有关实验操作或判断不正确的是 _________
A.用10 mL量筒量取稀硫酸溶液 8.0 mL B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填序号)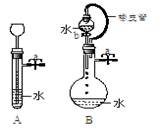
A.漏气 B.不漏气 C.不能确定
②关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填序号)A.漏气 B.不漏气 C.不能确定
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为
②.当Fe2+与Br-同时被氧化时,a的取值范围为
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为比
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):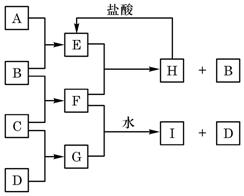
请填写下列空白:
①.A是,C是。
②.H与盐酸反应生成E的化学方程式是。
③.E与F反应的化学方程式是。
④.F与G的水溶液反应生成I和D的离子方程式是。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液的实验如下:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| (4)取(3)中的上层清夜,加AgNO3 |
有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 |
有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
①.溶液中一定存在的离子是;溶液中肯定不存在的离子是:
②.为进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细步骤)
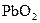 是很强的氧化剂,在酸性溶液中它可将
是很强的氧化剂,在酸性溶液中它可将 氧化成
氧化成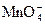 。取1支试管,加入少量
。取1支试管,加入少量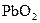 固体和2mL6 mol
固体和2mL6 mol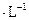
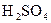 ,然后滴入2mL1 mol
,然后滴入2mL1 mol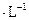
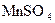 溶液。试回答:
溶液。试回答:
(1)搅拌后,溶液的颜色变化是_____________________________
(2)反应的化学方程式是___________,硫酸的作用是________________
(3)能否用盐酸代替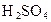 ________(填“能”或“不能”),用化学方程式回答
________(填“能”或“不能”),用化学方程式回答
_______________