某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)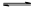 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.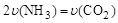 B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:_______________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(2)已知:NH2COONH4+2H2O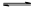 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。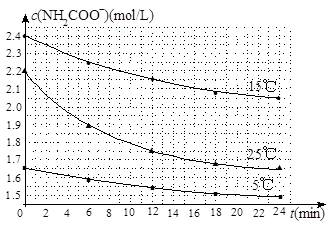
④计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_____________________。
⑤根据图中信息,如何说明水解反应速率随温度升高而增大:_________________。
X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同;②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的。
根据以上信息,请回答下列问题:
(1)Y的化学式为,X的电子式为。
(2)试比较M和N的稳定性:MN(填“>”、“<”、“=”)
(3)检验X的方法是。
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有,属于共价化合物的有(各任写一种物质的化学式)
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如下图,则该复盐的化学式为。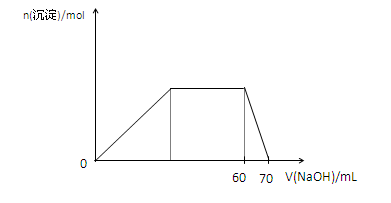
某元素M所形成的气态单质为双原子分子,共有三种形式,其式量分别为70、72、74,它们的物质的量之比为9∶6∶1,则:
(1) M有______种同位素,其质量数分别为_________________;
(2)各种同位素所占的原子百分比分别为多少?
(3)M2的平均式量为多少?
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。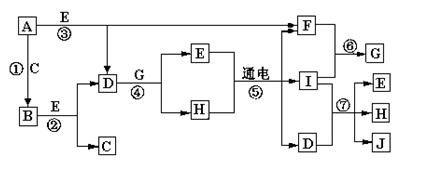
回答下列问题:
(1)B的化学式:,E的电子式_________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴、阳”)极附近溶液由无色变为红色,其原因是_________________ 。
如图所示: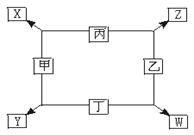
已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y, 在产物中元素甲呈负价。
在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是,乙是。
(2)甲与丙反应生成X的化学方程式是。
(3)乙与丁反应生成W的化学方程式是。
(1)1mol丙酮(CH3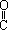 COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是。
COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是。
(3)B的甲酯可以聚合,聚合物的结构简式是。