已知:I2+2 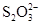 ===
=== 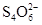 +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
 溶度积/25℃ 溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
(1)写出下列离子方程式:
A→B ; B→C+D 。
(2)溶液A中加入NaClO的目的是 。
(3)在溶液B中加入CuO的作用是 。
(4)操作①应控制的pH范围是: ;操作②的目的是 。
(5)由Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用“稍多量盐酸”和“低温蒸干”的目的是 。
含有C、H、O三种元素的有机物A、B、C、D,它们的实验式(最简式)相同。回的答下列问题:



(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,1 mol A完全燃烧生成1 mol CO2和1 mol H2O.则A的分子式为;
(2)有机物B是日常生活中一种调味品的成分。B能和Na2CO3反应放出气体,在一定条件下能与乙醇反应。写出B与乙醇反应的化学方程式。
(3)有机物C是一种白色固体有甜味,常用于制镜工业,写出C新制氢氧化铜的化学反应方程式。
(4)有机物D的相对分子质量是A的3倍,D具有酸性,1 mol D与足量Na反应生成22.4 L H2 (标准状况),D具有下列转化关系:
D的结构简式


D→E的化学方程式
M→N的化学方程式反应类型
D→P的化学方程式反应类型
已知苯酚能跟碳酸钠溶液反应而溶解于碳酸钠溶液中。在下图所示的转化关系中,括号内编号①—④表示转化所需化学试剂:


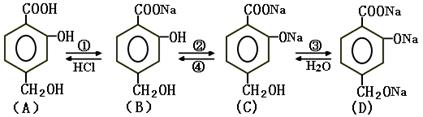
(1)用化学式填空:
①是、②是、
③是、④是、
(2)写出A直接生成C的化学反应方程式:
为除去下表所列物质含有的少量杂质(括号内为杂质),在A项中选择试剂,在B项中选择操作的方法,将其代号填入表中:


A:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;
(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液。
B:(1)过滤;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;
(6)洗气;(7)渗析
| 物质 |
蛋白质溶液 (氯化钠溶液) |
乙烷 (乙烯) |
肥皂 (甘油) |
乙醇(水) |
乙酸乙酯(乙酸) |
溴苯(溴) |
| 加入试剂 |
||||||
| 操作方法 |
下列文字表述与反应方程式对应且正确的是()


| A.溴乙烷中直接滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓ |
| B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑ |
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.实验室用液溴和苯在催化剂作用下制溴苯: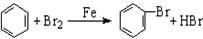 |