一块表面被氧化的钠质量是8.5g,投入到水中,完全反应得到标准状况下的H2 0.1g,则原钠块中被氧化的钠的质量是
| A.2.3g | B.4.6g | C.6.2g | D.7.8g |
进行一氯取代后,只能生成三种沸点不同产物的烷烃是
| A.(CH3)2CHCH2CH2CH3 | B.(CH3)3CCH2CH3 | C.(CH3)2CHCH(CH3)2 | D.(CH3)2CHCH3 |
绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下几种生产乙苯(反应均在一定条件下进行)的方法中符合绿色化学原理的是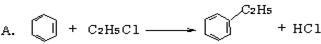
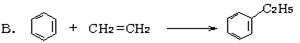

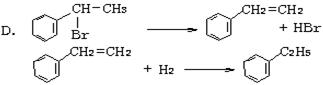
下列除杂方法正确的是
| A.用H2除去乙烷中混有的少量乙烯 |
| B.用酸性KMnO4溶液除去甲烷中混有的少量乙烯 |
| C.用饱和Na2CO3溶液除去乙酸乙酯中混有的少量乙醇和乙酸 |
| D.用金属钠除去乙醇中混有的少量水 |
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
冶炼金属一般有三种方法,则冶炼银、铁、钠应分别采用
| A.热还原法、热分解法、电解法 | B.热分解法、热还原法、电解法 |
| C.电解法、热分解法、热还原法 | D.热分解法、电解法、热还原法 |