晶态氯化钠是 晶体,晶体中,每个钠离子周围有 个氯离子,每个氯离子周围有 个钠离子,钠离子半径比氯离子半径 。在氯化物MCl中,M在第六周期,是钠的同族元素,该晶体中,每个阳离子周期有 氯离子。钠的金属性比M 。氯化钠的电子式是 ,熔融后 导电(填“能”或“不能”)。Na+(或Cl-)周围的6个Cl- (或Na+)相邻的连线构成的面是 多面体;每个Na+(或Cl-)周围与之距离最近且距离相等的Na+(或Cl-)有 个?
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。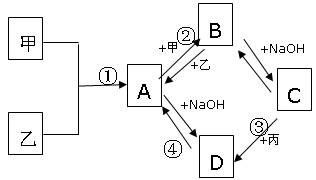
(1)写出下列物质的化学式;乙___________ ;B ___________。
(2)写出③反应的化学方程式:____________________ 。
(3)写出②反应的离子方程式:_______________________ 。
有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:(1)将固体粉末溶于水得无色溶液和白色沉淀;(2)加入稀盐酸,沉淀部分溶解且有气泡产生。根据以上实验所产生得现象,判断这种混合物里,一定含有的物质是___________,一定没有的物质是__________,可能有的物质是__________。请设计实验证明可能有的物质__________________。
(1) (6分)已知氯气通入热的苛性钠溶液中会发生如下反应:
3Cl2+6NaOH="5NaCl+" NaClO3+3H2O
①反应中还原剂是____________(填化学式);
②把此反应改写成离子方程式:______________________;
③若消耗106.5gCl2,则生成的氧化产物的物质的量是____________________ 。
(2)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:
4Zn + 10HNO3(稀) ="==" 4Zn(NO3)2 + NH4NO3 + 3H2O
含苯酚的工业废水的方案如下图所示: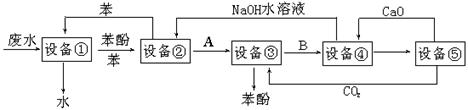
回答下列问题:
⑴设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是;
⑵由设备②进入设备③的物质A是,由设备③进入设备④的物质B是;
⑶在设备③中发生反应的化学方程式为;
⑷在设备④中,物质B的水溶液和CaO反应,产物是、和水,可通过操作(填写操作名称)分离产物;
⑸上图中,能循环使用的物质是C6H6、CaO、、。
现有下列5种有机化合物:
| A.CH3OH | B.(CH3)3CCH2OH | C.(CH3)3COH | D.(CH3)2CHOH |
E、C6H5CH2OH
(1)能氧化成醛的是。
(2)不能消去成烯的是。
(3)能氧化成酮的是。