如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)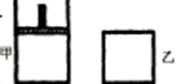
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
(1)在“糖类、蛋白质、油脂、维生素、水、矿物元素”六大营养素中,为人体提供能量物质有___________________________________________。
(2)淀粉属于哪一类营养素?____________,彻底水解的产物是_______________。
(3)人体摄入的油脂,在酶的催化作用下发生水解的产物是_____________和_____________。
(4)人体摄入的蛋白质,在酶的催化作用下发生水解的最终产物是_______________。
某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:
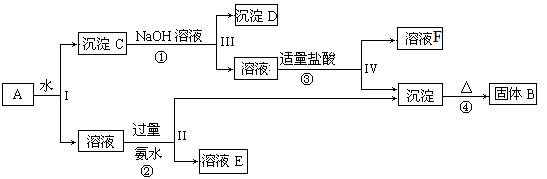
据此回答下列问题:
(1) I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2) 根据上图反应关系,写出下列B、F所含物质成分的化学式:B ; F。
; F。
(3) 写出过程反应①的离子方程式,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式。
(4)写出③中盐酸过量时的离子反应方程式  。
。
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol・L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol・L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下 列填空:
列填空:
(1)在实验1,反应在10 min至20 min时间内平均速率为mol・L-1・min-1
(2)在实验2,A的初始浓度C2=mol・L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验 3的反应速率为V3,实验1的反应速率为V1,则V3V1(选填“>”、“=”、“<”),且C31.0 mol・L-1(选填“>”、“=”、“<”)。
3的反应速率为V3,实验1的反应速率为V1,则V3V1(选填“>”、“=”、“<”),且C31.0 mol・L-1(选填“>”、“=”、“<”)。
(4)比较实验4和实验1,可 推测该反应是________反应(选填“吸热”或“放热”)。理由是__________。
推测该反应是________反应(选填“吸热”或“放热”)。理由是__________。
(6分)将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况(填写金属或金属离子,用化学符号表示)。
(1) 充分反应后,如果Fe有剩余,则容器内不可能有;
(2) 充分反应后,如果容器内还有大量Fe3+,不可能有;
(3) 充分反应后,如果容器内有较多Cu2+和较多的Cu,则容器内不可能有。
完成并配平下列化学方程式□FeO + □HNO3——□Fe(NO3)3 + NO↑+ □,
该反应中氧化剂是,当生成2mol NO时,转移的电子数为NA。