下列有关叙述中,正确的是
| A.需要加热才能发生的反应就一定是吸热反应 |
| B.将Ba(OH)2·8H2O晶体与NH4Cl晶体混合、搅拌,会放出大量的热 |
| C.在反应2CO+O2==2CO2中,反应物的总能量高于生成物的总能量 |
| D.1mol CaCO3固体完全分解会吸收178.5kJ的热量,其热化学方程式表示为:CaCO3 ="=" CaO + CO2△H = +178.5kJ·mol-1 |
把0.6molX气体和0.4molY气体混和于2L容器中,使它们发生如下反应:
3X(g) + 2Y(g) 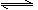 nZ(g) + 2W(g) 5分钟末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/(L· min),则上述反应中Z气体的计量数n的值是
nZ(g) + 2W(g) 5分钟末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/(L· min),则上述反应中Z气体的计量数n的值是
| A.1 | B.2 | C.3 | D.4 |
反应C(s)+H2O(g) CO(g)+H2(g)在一密闭容器中进行并达平衡。下列条件的改变使H2O(g)的转化率增大的是
CO(g)+H2(g)在一密闭容器中进行并达平衡。下列条件的改变使H2O(g)的转化率增大的是
| A.增加C(s)的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入氩气使体系压强增大 |
| D.保持压强不变,充入氩气使容器体积增大 |
高温下14CO2与碳发生反应:14CO2+C 2CO达到平衡后,平衡混合物中含14C的粒子有
2CO达到平衡后,平衡混合物中含14C的粒子有
| A.14CO214CO14C | B.14CO214CO | C.14CO2 | D.14CO |
对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
| A.升高温度 | B.增大压强 | C.增大容器体积 | D.增大反应物浓度 |
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |