对于可逆反应N2(g)+3H2(g) 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(H2)=0.005 mol/(L·s) | B.v(NH3)=0.01 mol/(L·s) |
| C.v(N2)=0.2 mol/(L·min) | D.v(H2)=0.4 mol/(L·min) |
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是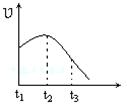
| A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高 |
| B.从t1→t2的主要原因是镁与水反应,致使酸的浓度升高 |
| C.从t2→t3的主要原因是随着反应的进行镁体积减少 |
| D.从t2→t3的主要原因是随着反应的进行温度越来越低 |
对于放热反应2H2+O2====2H2O,下列说法正确的是
| A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 |
| B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 |
| C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 |
| D.反应物H2和02具有的能量相等 |
下列有关比较中正确的是
| A.酸性: H3PO4> HNO3 | B.稳定性: HBr > HCl |
| C.金属性: Na > K | D.非金属性: Cl > S |
下列说法中正确的是
| A.人类历史上使用最早的合金是生铁 |
| B.目前世界上使用量最大的合金是铝合金 |
| C.目前世界上用途最广的合金是钢 |
| D.合金比纯金属更适合做导线 |