(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(2)已知:C3H8(g ) ==== CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如右表:已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
| 物 质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
把5.1g镁铝合金的粉末放入500mL1mol·L-1盐酸中,恰好完全反应。试计算:
(1)该合金中镁和铝的物质的量各为多少mol。
(2)将等质量的该合金投入到足量的氢氧化钠溶液中,求标况下放出气体的体积。
用15.8g高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的盐酸以制取氯气。反应如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0. 2 m
2 m ol·L-1·s-1,同时生成1 mol D。试求:
ol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
以石墨为电极,电解1L硫酸铜和氯化钠的混合溶液,其中硫酸铜与氯化钠的物质的量之和为0.2mol,硫酸铜的物质的量占总物质的量的比值为x。
若x=0.5,当Cu2+在阴极恰好全部析出时,阳极产生的气体是什么?其物质的量是多少?所得溶液的pH是多少?
将镁和铝的混合物0.1 mol溶于100 mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积( V)变化如图所示。请回答:
V)变化如图所示。请回答: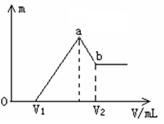
(1)若当V1=160时,则金属粉末中
n(Mg)=mol,V2=mL;
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积应为mL。