常温下列各种溶液中,可能大量共存的离子组是( )
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、I- |
| B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、AlO2-、S2-、CO32- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.能使PH试纸显红色的溶液:Mg2+、SO42-、Na+、Cl- |
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。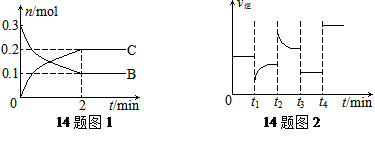
下列有关说法正确的是
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
下列各组物质中,不能满足“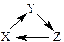 ”转化关系的一组是
”转化关系的一组是
| X |
Y |
Z |
|
| A |
Si |
SiO2 |
Na2SiO3 |
| B |
CH2=CH2 |
CH3CH2Br |
CH3CH2OH |
| C |
Al2O3 |
NaAlO2 |
Al(OH)3 |
| D |
Cu |
CuO |
CuSO4 |
2008年诺贝尔化学奖授予美籍华裔钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白方面做出的杰出贡献。绿色荧光蛋白是一种蛋白质。有关绿色荧光蛋白的有关说法中,错误的是
| A.属于高分子化合物 |
| B.水解后可得到多种氨基酸 |
| C.可用于蛋白质反应机理的研究 |
| D.加入CuSO4溶液后所得的沉淀能用于水 |
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LnaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是()
| A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为100mL |
| B.当金属全部溶解时收集到NO气体的体积为2.24L |
| C.参加反应的金属的总质量一定是6.6g |
| D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
右图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是()
A.该反应的化学方程式可表达为2M+N 2P 2P |
| B.在反应时间为20min—25min之内,物质 M的反应速率为0.002mol/(L·min) |
| C.当反应时间为20min时,曲线开始发生变化 的原理可能是由于增大压强引起的 |
| D.反应在10min达到化学平衡状态,若曲线的 |
变化是由于升温造成的(其它条件不变),
则该反应的正反应一定为吸热反应