下列实验设计及其对应的离子方程式均正确的是
| A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: 2MnO4- + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O |
| B.Na2O2与H2O反应制备O2:Na2O2 + H2O = 2Na+ + 2OH- + O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO- |
| D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+= Cu2+ + 2Fe2+ |
用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为()
| A.0.5 mol/L | B.2 mol/L | C.l mol/L | D.无法确定 |
浓度都是0.1 mol·L-1的弱酸HX溶液与NaX溶液等体积混合后,在所得溶液中,有关离子浓度的关系错误的是()
| A.C(Na+)+C(H+)=C(X-)+C(OH-) |
| B.C(X-)+ C(HX)=2C(Na+) |
| C.若混合物呈酸性, 则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-) |
| D.若混合物呈碱性, 则C(Na+)>C(HX)>C(X-)>C(OH-)>C(H+) |
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:()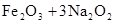

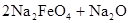 ,下列说法正确的是
,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A.2Na218O2 + 2H2O = 4Nal8OH + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑+ 8H2O |
C.NH4Cl + 2H2O  NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O |
能解释下列原理的离子反应方程式正确是()
| A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C.用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++ Cu=Fe2++ Cu2+ |
| D.用氢氧化钠溶液除去铝表面的氧化膜: Al2O3+2OH-+2H2O=2Al(OH)3 |