铜与浓硝酸反应的化学方程式如下:Cu +4HNO3(浓)==Cu(NO3)2+2 NO2↑+2H2O将 3.2 g铜完全溶于足量的 50 mL 11.0 mol•L-1的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50 mL。试计算
(1)反应后可生成标准状况下NO2气体多少 L? (写计算过程)
(2)反应后溶液中NO3-物质的量浓度为_________________________。
将镁、铝的混合物0.1 mol溶于100 mL 2 mol/L的H2S04溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1="160" mL时,则金属粉末中,
n(Mg) =()mol,V2=()mL。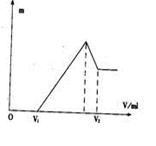
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13 +刚好沉淀完全,则滴入NaOH溶液的体积)mL。
(6分)向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,则参加反应的NaOH的物质的量为________;原NaOH溶液的物质的量浓度为________;生成标准状况下H2的体积为__________。
将镁、铝的混合物共0.2 mol, 溶于200 mL 4 mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题: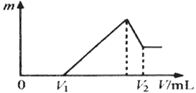
(1)若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。当V1="160" mL时,则金属粉末中n (Al)=mol;
(2)0~V1段发生的反应的离子方程式为;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL;
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol·L—1的硫酸溶解此混合物后,再加入840mL 2 mol·L—1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为。
向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题: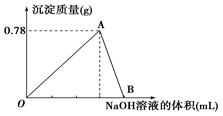
(1)图中A点表示的物质是,AlCl3溶液的浓度为。
(2)O点到B点反应的总离子方程式可表示为。
(3)向图中B点溶液中滴加10ml 1 mol·L-1的HCl溶液,可观察到的现象是:________________________
发生的反应是__________________________
(4)若向20 mL该AlCl3溶液中加入一定体积的2 mol·L-1的NaOH溶液,生成0.39g沉淀,问加入NaOH溶液体积为。
(10分)铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用实验的方法。实验中称取0.54 g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值 (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;