某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的质量分数是( )
| A.26.5% | B.30% |
C.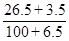 ×100% ×100% |
D.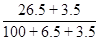 ×100% ×100% |
下列说法错误的是
| A.钠在空气中燃烧所得产物为Na2O2 |
| B.镁因在空气中形成了一薄层致密的氧化膜,保护了里面的镁,故镁不需要像钠似的进行特殊保护 |
| C.铝制品在生活中非常普遍,这是因为铝不活泼 |
| D.铁在潮湿的空气中因生成的氧化物很疏松,不能保护内层金属,故铁制品往往需涂保护层 |
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是
常温下能用铝制容器盛放的是
| A.稀硫酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.硫酸铜溶液 |
化学知识在日常生活中有很多应用,下列说法正确的是
| A.用食盐清洗热水瓶中的水垢 |
| B.漂白粉在空气中容易变质的原因是Ca(ClO)2见光分解 |
| C.加碘食盐,能使淀粉显蓝色 |
| D.氯水应避光保存,是因为HClO见光分解 |
“脚印”、“笑脸”、“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些焰火与元素的焰色反应有关。下列说法错误的是
| A.观察K2SO4的焰色应透过蓝色的钴玻璃 |
| B.Na与NaCl在灼烧时火焰颜色相同 |
| C.可以用焰色反应来区别NaCl和KCl |
| D.焰色反应一定发生化学变化 |