下列叙述中正确的是 ( )
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
物质的量浓度相同时,下列既能与NaOH溶液反应、又能跟盐酸溶液反应的溶液中pH最大的是
| A.Na2CO3溶液 | B.NH4HCO3溶液 | C.NaHCO3溶液 | D.NaHSO4溶液 |
如图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏燃料(S)涂覆在 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: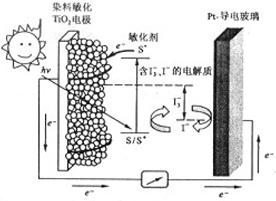
 (激发态)
(激发态)
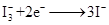

下列关于该电池叙述错误的是:
| A.电池工作时,是将太阳能转化为电能 |
| B.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| C.电池中镀铂导电玻璃为正极 |
| D.电池的电解质溶液中I-和I3-的浓度不会减少 |
关于下列各装置图的叙述中,不正确的是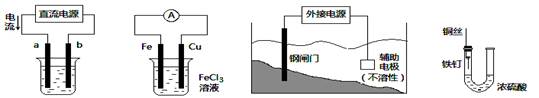
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.为防止钢闸门被腐蚀,装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是
| A.碳棒接直流电源的负极 |
| B.碳棒上发生还原反应 |
| C.铁片上的电极反应式为2Cl――2e- = Cl2↑ |
| D.铁片附近出现的浑浊物是Mg(OH)2 |
一种强酸HA溶液中加入一种碱MOH反应后,溶液呈中性,下列判断正确的是
| A.加入的碱一定过量 |
| B.混合前酸与碱中溶质的物质的量一定相等 |
| C.生成的盐一定不发生水解 |
| D.反应后溶液中A-、M+物质的量浓度一定相等 |