(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式 。
(2)写出可溶性铝盐与过量氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
(II)环境专家认为可以用金属镁将水体中的NO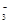 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH 、Mg(OH)2、NO
、Mg(OH)2、NO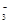 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下: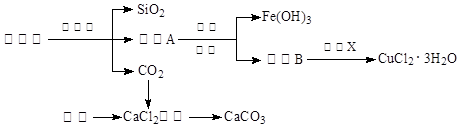
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 |
pH (开始沉淀) |
pH(完全沉淀) |
| Fe(OH)3 |
1.9 |
3.2 |
| Fe(OH)2 |
7.0 |
9.0 |
| Cu(OH)2 |
4.7 |
6.7 |
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至(填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是。
⑵操作X包括、、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①操作c中量取盐酸体积的仪器是。
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将(选填“偏大”、“偏小”或“无影响”)。
③若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为。
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为mol·L-1。(2)等体积的下列溶液中,阳离子的总物质的量最大的是。(填序号)。
① 0.2 mol·L-1的CuSO4溶液② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺。(填序号)。
①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4
(4) 水的电离平衡如图所示:
①若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从增加到。
②100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是。
一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为,x=;
②若反应经2min达到平衡,平衡时C的浓度0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件(可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入molA气体molB气体。
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g)ΔH=+131.3 kJ•mol-1,
CO(g)+H2(g)ΔH=+131.3 kJ•mol-1,
①该反应在常温下自发进行(填“能”与“不能”);
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有
Ⅰ混合气体的密度;Ⅱ容器内气体的压强;
Ⅲ混合气体的总物质的量;ⅣCO物质的量浓度
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ D.Ⅰ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气。反应为H2O(g)+CO(g)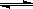 H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是。
H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)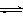 CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ•mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ•mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
①下列措施中能使c (CH3OH)增大的是。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2和3mol H2
②在温度T1时,当反应达到平衡时,测得n(H2) =" 2.4" mol;其它条件不变,在温度T2时,当反应达到平衡时,测得n(CO2) =" 0.82" mol,则T2 T1。(填“>”、“<”或“=”),
(4)在一定条件下科学家从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol。
①写出工业上以CO2、H2合成CH3OH和液态水的热化学方程式:;
②该转化的积极意义是;
③有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1) 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热ΔH=。
(2)今有如下两个热化学方程式:则ab(填>, =" ," <)
H2(g)+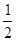 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1
H2(g)+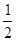 O2(g) = H2O(l)ΔH2=b kJ·mol-1
O2(g) = H2O(l)ΔH2=b kJ·mol-1
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)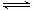 2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:(写出 + 或-)。
2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:(写出 + 或-)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热△H =。