(1)化学就在我们身边,它能改善我们的生活。请从“A氧气 B氮气 C氢气D天然气 E石墨”中选择适当的物质填空。
①被称为理想的“绿色能源”是 ;②可用于医疗急救的物质是 ;
③焊接金属时常用作保护气的是 ;④可用于制铅笔芯的是 ;
⑤比较清洁的化石燃料是______ 。
(2)下图是某品牌矿泉水标签的部分内容,请按要求填写:
健康饮水新概念
饮水质量好坏对人体健康至关重要,矿物质水含钾.镁等游离态矿物质元素,补充人体所需,让身体保持健康与活力。喝的健康,生活更健康!
主要成分:钾离子:1.0-27.0 mg∕L 氯离子:1.0-24.0 mg∕L
镁离子:0.1-5.0 mg∕L 硫酸根离子:0.4-20.0 mg∕L
①用离子符号表示出其中的一种阳离子 ;②表示出二个硫酸根离子 ;
③矿物质水的主要成分是水,请用化学符号表示水中氧元素的化合价 ;
①二氧化碳是一种没有颜色、没有气味的气体,密度比空气大;②二氧化碳能使澄清石灰水变浑浊③点燃镁条在二氧化碳中燃烧;④冒黑烟、发光、生成白色固体;⑤生成了氧化镁和碳;⑥二氧化碳可用于灭火、制冷剂等。
上述叙述中:(填序号) 是物理性质; 是化学性质; 是化学变化;
是现象; 是用途。
下列事实说明空气中存在哪些物质。
(1)昆虫在盛有空气的密闭容器中能生存一段时间____________。
(2)酥脆的饼干放置在空气中一段时间后变软了____________。
如图所示,这是一瓶用排水法收集后摆放在桌子上的无色气体,据此,请你推断出除“无色”、“气体”的另2条此气体所具备的物理性质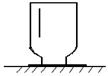
(1)___________。
(2)___________。
请指出下列操作可能造成的不良后果。
(1)倾倒液体药品时,试剂瓶标签没有朝向手心
(2)胶头滴管取用试剂后,将其倒置 ;
用文字表达式完成下列反应,并在括号中注明反应的基本类型。
(1)铁在氧气中燃烧: ()
(2)磷在空气中燃烧: ()
(3)硫在空气中燃烧: ()