可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
下列电离方程式中,书写正确的是 ( )
| A.Cu(OH)2=Cu2+ + 2 OH- | B.NH3·H2O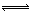 NH4+ + OH- NH4+ + OH- |
| C.HF= H+ + F- | D.H3PO4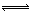 3 H+ + PO43- 3 H+ + PO43- |
一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
| A.c1∶c2=1∶3 | B.平衡时,Y和Z的生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1<0.14 mol·L-1 |
在一定温度下的密闭容器中存在如下反应:2SO2+O2 2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
| A.向正反应方向进行 | B.向逆反应方向进行 | C.达到平衡状态 | D.无法判断 |
将0.5molPCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
A.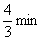 |
B. |
C.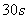 |
D.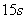 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )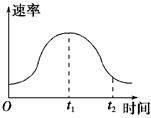
| A.盐酸的浓度 | B.镁条的表面积 | C.Cl-的浓度 | D.溶液的温度 |