亚氯酸盐(NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2==4ClO2 +H++Cl-+2H2O分解时,刚加入硫酸时反应缓慢,随后突然反应释放出ClO2,这是因为( )
| A.酸使亚氯酸的氧化性增强 | B.溶液中的H+起催化作用 |
| C.溶液中的Cl-起催化作用 | D.逸出的ClO2使反应的生成物浓度降低 |
下列比较,正确的是
A稳定性 H2S>HCl>HBr>HI B.酸性 HClO4>H2SO4>CH3COOH>H2CO3
C.粒子半径 S2-<Cl-<K+<Ca2+ D.沸点 HI>HBr>HCl>HF
下列说法中正确的是
A.某微粒核外电子排布的结构为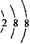 ,则该微粒一定是氩原子 ,则该微粒一定是氩原子 |
| B.r(Na+)>r(F-) |
| C.F-、S2-、Na+、Mg2+是与Ne原子具有相同电子层结构的离子 |
| D.NH4+与H3O+具有相同的质子数和电子数 |
a mol FeO 与b mol FeS投入V L、c mol/L的硝酸溶液中,恰好完全反应,产生d mol NO气体和Fe(NO3)3、H2SO4的混合溶液,未被还原的硝酸不可能是
| A.(21a+189b) g | B.3(a+b) mol | C.189(a+b) g | D.(VC-d) mol |
某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
| A.②→④→①→③→⑤ | B.②→①→③→④→⑤ |
| C.③→①→②→⑤→④ | D.①→③→⑤→②→④ |
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是: