氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-==3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。右图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率—时间图像。下列说法不正确的是( )
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物浓度减小 |
| D.图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量浓度的减小值 |
关于结构如下图所示的有机物的叙述中正确的是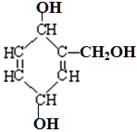
| A.1mol此有机物与足量Na发生反应,有3molH2生成 |
| B.分子中有3个手性碳原子 |
| C.分子中sp2、sp3杂化的原子个数比为1∶1 |
D.1mol此有机物与足量H2发生加成反应,有2mol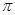 键断裂 键断裂 |
下列说法正确的是
| A.有些物质是由分子直接构成的,化学式能准确表示该物质分子组成,如白磷(P4)、二氧化碳(CO2)、氯化铵(NH4Cl)等 |
| B.C2H2与BeCl2分子中的中心原子杂化轨道的类型相同 |
| C.在1molSiO2晶体中,含有2molSi-O键 |
| D.二甲苯的沸点顺序是:邻二甲苯>对二甲苯;则羟基苯甲醛的沸点顺序是:邻羟基苯甲醛 >对羟基苯甲醛 |
下列有关金属的说法不正确的是
| A.金属的导电性、导热性、延展性都与自由电子有关 |
| B.六方最密和面心立方最密的原子堆积方式空间利用率最高 |
C.钠晶胞结构如下图,钠晶胞中每个钠原子的配位数为6 |
| D.温度升高,金属的导电性将变小 |
下面的排序错误的是
| A.晶体熔点由高到低:MgO> H2O > NH3 |
| B.熔点由高到低:金刚石>生铁>纯铁>钠 |
| C.硬度由大到小:金刚石>碳化硅>晶体硅 |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是
| A.该元素原子最外层共有3个电子 |
| B.该元素位于第5周期ⅡA族 |
| C.该元素原子核外第N层上共有9个不同状态的电子 |
| D.该元素原子第四电子层上有5个空轨道 |