下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )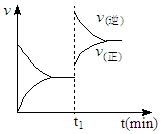
| A.2SO2(g)+O2(g) ⇌2SO3(g);ΔH<0 |
| B.4NH3(g)+5O2(g) ⇌4NO(g)+6H2O(g);ΔH<0 |
| C.H2(g)+I2(g) ⇌2HI(g); ΔH>0 |
| D.C(s)+H2O(g) ⇌CO(g)+H2(g);ΔH>0 |
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。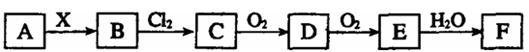
下列说法中不正确的是()
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是()
| A.青石棉是一种易燃品且易溶于水 |
| B.青石棉的化学组成用氧化物的形式可表示为:Na2O·FeO·2Fe2O3·8SiO2·H2O |
| C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6L3mol/LHNO3溶液 |
| D.1mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5L2mol/LHF溶液 |
关于某溶液中所含离子的鉴别,下列判断正确的是()
| A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- |
| B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+ |
| C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ |
| D.加盐酸生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3主要: Cu2+ + CO32─ + H2O = Cu(OH)2↓ + CO2↑
次要:Cu2+ + CO32─= CuCO3↓(几乎不发生反应。下同)
(2) CuSO4 +Na2S主要: Cu2+ + S2─ ="" CuS↓
次要: Cu2+ + S2─ + 2H2O = Cu(OH)2↓ + H2S↑
则下列几种物质的溶解度大小的比较中,正确的是()
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为
Na+:Mg2+:Cl-=3:5:5,若Na+浓度为3mol/L,则SO42-的浓度为( )
| A.2mol/L | B.3mol/L | C.4mol/L | D.8mol/L |