某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )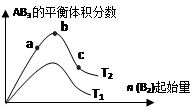
| A.反应速率a>b>c |
| B.达到平衡时,AB3的物质的量大小为:b > c > a |
| C.若T2>T1,则正反应一定是吸热反应 |
| D.达到平衡时A2的转化率大小为:b>a>c |
有下列物质:①丁烷②2-甲基丙烷③戊烷④ 2-甲基丁烷⑤2,2-二甲基丙烷,它们的沸点排列顺序正确的是
1993年的世界十大科技新闻称中国学者徐志傅和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成,关于此物质说法错误的是
| A.是烃类化合物 | B.常温下呈固态 |
| C.分子中可能含不饱和碳原子 | D.不能在空气中燃烧 |
两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水。下列说法正确的是
| A.一定有甲烷 | B.一定是甲烷和乙烯 | C.可能有乙烷 | D.一定有乙炔 |
下列物质具有顺反异构体的是
| A.1,2-二氯丙烯 | B.丙烯 | C.2-甲基-2-丁烯 | D.2-氯-2-戊烯 |
以下说法正确的是
| A.同分异构体之间分子式相同,其式量也一定相等,式量相等的物质一定是同分异构体 |
| B.同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体 |
| C.两种物质如果互为同分异构体,则一定不可能为同系物 |
| D.两种物质如果互为同分异构体,则它们的命名可能一样 |