根据下列热化学方程式:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+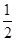 O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH 3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
| A.ΔH =+244.1 kJ/mol | B.ΔH =-488.3 kJ/mol |
| C.ΔH =-996.6 kJ/mol | D.ΔH =+996.6 kJ/mol |
有关氨气的说法正确的是
| A.氨气与氯气相遇可能冒白烟 |
| B.氨气通入浓硫酸或浓硝酸中会被氧化 |
| C.氨气可以由所有铵盐受热分解得到 |
| D.氨气比PH3易液化是因为N−H键的键能比P−H键能大 |
两种短周期元素X和Y形成的单质能与氢气反应生成HX和HY,反应热分别为Q1和Q2,已知Q1>Q2,,则判断一定正确的是
| A.沸点:HY>HX | B.还原性:HY>HX |
| C.稳定性:HY>HX | D.酸性:HXO4>HYO4 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| C.12 g石墨和C60的混合物中质子总数一定为6NA个 |
| D.常温常压下,22.4L乙烯中C−H键数为4NA |
将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象
| A.水层显棕黄色 | B.水层无色 | C.四氯化碳层显红棕色 | D.四氯化碳层无色 |
关于晶体的叙述中,正确的是
| A.原子晶体中,共价键的键能越大,熔、沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔、沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |