能正确表示下列反应的离子方程式是
| A.硫酸铝溶液中加入过量氨水 Al3++3OH-= Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-= CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-= ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉 2Fe+6H+= 2Fe3++3H2↑ |
向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,所得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )。
A.0.75 mol·L-1 B.1 mol·L-1 C.1.5 mol·L-1 D.2 mol·L-1
下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2 |
| C.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe |
D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO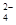 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓ +Ba2++3OH-===Fe(OH)3↓+BaSO4↓ |
下列离子方程式正确的是( )
| A.少量金属钠加到冷水中:Na+2H2O===Na++2OH-+H2↑ |
B.NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO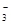 ===CaCO3↓+H2O ===CaCO3↓+H2O |
C.硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO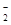 +4NH +4NH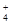 +2H2O +2H2O |
D.将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合:2Al3++7OH-===Al(OH)3↓+ AlO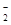 +2H2O +2H2O |
根据下列方程式(1)2Fe2++Cl2===2Fe3++2Cl-;(2)HClO+H++Cl-===Cl2+H2O;(3)2Fe3++Cu===2Fe2++Cu2+; (4)Fe+Cu2+===Fe2++Cu。判断下列各组物质氧化性强弱顺序正确的是( )。
| A.HClO>Cl2>Fe3+>Cu2+>Fe2+ | B.Fe3+>HClO>Cl2>Fe2+>Cu2+ |
| C.Cl2>HClO>Fe3+>Cu2+>Fe2+ | D.HClO>Fe3+>Cl2>Cu2+>Fe2+ |
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑ ②H++CO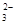 ===HCO
===HCO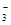 ③CO2+H2O+ClO-===HClO+HCO
③CO2+H2O+ClO-===HClO+HCO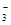 ④CO
④CO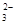 +HSO
+HSO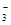 ===HCO
===HCO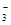 +SO
+SO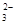 ,由此得出的如下结论中不正确的是
,由此得出的如下结论中不正确的是
A.CO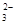 与H+、Ca2+不能大量共存 与H+、Ca2+不能大量共存 |
B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 | D.H2CO3、HClO都属于弱酸 |