在含有n克HNO3的稀溶液中,恰好将5.6克铁粉完全溶解,若有n/4克HNO3被还原成NO(无其它还原产物),则n值不可能是( )
| A.12.6克 | B.16.8克 | C.18.9克 | D.25.2克 |
等浓度的下列物质的水溶液,加热到80℃,忽略水的蒸发,溶液的pH不变的是()
| A.Na2CO3 | B.NaOH | C.Na2SO4 | D.H2SO4 |
下列各组离子可能大量共存的是()
| A.pH=1的溶液中:Fe2+、A13+、Cl-、MnO4- |
| B.能与金属铝反应放出氢气的溶液:K+、NO3-、Cl-、NH4+ |
| C.能使酚酞试液变红的溶液中:Na+、Cl-、S2-、SO32- |
| D.含有大量H+的无色溶液中:Na+、Cu2+、A1O2-、SiO2- |
化学新教材中,常借助于图像,这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是()
某原电池总反应为:Cu+2Fe3+Cu2++2Fe2+,下列能实现该反应的原电池是()
| A |
B |
C |
D |
|
| 电极材料 |
Cu、Zn |
Cu、Ag |
Cu、C |
Fe、Zn |
| 电解液 |
FeCl3 |
Fe2(SO4)3 |
Fe(NO3)2 |
CuSO4 |
肉毒碱是具有多种生理功能的氨基酸类物质,又名维生素Bt,是一种类维生素。1927年测定了它的结构,1958年发现其能促进脂肪代谢,1985年被指定为“多功能营养品”。下列有关肉毒碱的说法不正确的是()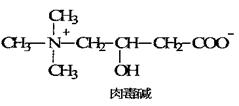
| A.肉毒碱的分子式为:C7H15NO3 |
| B.肉毒碱能与氢氧化钠反应但不能与盐酸反应 |
| C.一定条件下肉毒碱能发生酯化反应、消去反应、取代反应 |
| D.H核磁共振谱(1H-NMR)证明分子中的3个甲基上的氢属等效氢 |