NA为阿伏加德罗常数,下列叙述正确的是( )
| A.16 g氧气和16 g臭氧所含的原子数均为NA |
| B.常温常压下,11.2L氯气所含的原子数目为NA |
| C.2.3g钠由原子变成离子,失去的电子数为1.1NA |
| D.28g N2中所含的质子数目为7NA |
相同温度下,体积均为0.5L的两个恒容密闭容器中发生可逆反应:
2XY2(g) + Y2(g)  2XY3(g)△H=-Q kJ·mol-1(Q>0)
2XY3(g)△H=-Q kJ·mol-1(Q>0)
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| XY2 |
Y2 |
XY3 |
||
| ① |
2 |
1 |
0 |
放热 0.25 Q kJ |
| ② |
1.2 |
0.6 |
0.8 |
下列叙述不正确的是
A.容器①、②中反应的平衡常数均为1/13.5
B.达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol·L-1
C.容器②中反应达到平衡时放出的热量为0.15 Q kJ
D.若容器①的其他条件不变,恒压下通入稀有气体,则达到平衡时放出的热量小于0.25 Q kJ
标准状况下分别向甲、乙、丙三个容器中加入30.0 mL同浓度的盐酸,再加入不同质量的由两种金属组成的同种合金粉末,测量放出气体的体积。另在甲、乙、丙三个容器中加入30.0 mL与盐酸同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积。所得数据如下表所示:
| 反应容器 |
甲 |
乙 |
丙 |
| 合金的质量/g |
0.510 |
1.53 |
3.57 |
| 与盐酸反应产生气体的体积/L |
0.560 |
0.672 |
0.672 |
| 与氢氧化钠反应产生气体的体积/L |
0.336 |
x |
y |
根据表中数据不可能得出的结论是
A.盐酸的物质的量浓度为2 mol·L-1B.合金可能由镁与铝组成
C.x=2.016D.y=2.016
乙醇在甲烷菌的作用下可以转化为甲烷,有人对该反应曾做过如下的同位素实验(D、T为H的同位素):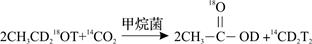
在同样条件下,下列反应的产物分别为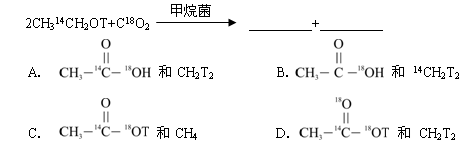
某无色溶液,仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+、CO32─ | B.CO32─、Na+、Al3+ |
| C.Na+、CO32─、AlO2─ | D.MnO4─、Na+、CO32─ |
为达到预期的实验目的,下列操作正确的是
| A.可用饱和食盐水鉴别蛋白质溶液和肥皂水 |
| B.苯酚和甲醛在浓盐酸的作用下可得到体型的酚醛树脂 |
| C.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 |
| D.将饱和AlCl3溶液、Al(OH)3胶体加热蒸干并灼烧,产物相同 |