于密闭容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右下图所示。则符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右下图所示。则符合图示的正确判断是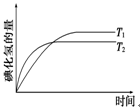
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 | C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
可逆反应2SO2(g)+O2(g) 2SO3(g),根据下表中的数据判断下列图像错误的是
2SO3(g),根据下表中的数据判断下列图像错误的是
 |
pl(Mpa) |
P2(Mpa) |
| 400℃ |
99.6 |
99.7 |
| 500℃ |
96.9 |
97.8 |

下列各组离子或分子在指定溶液中一定能大量共存的是
| A.能使pH试纸呈红色的溶液:Fe2+、Mg2+、NO3-、Cl— |
| B.在饱和的氯水中:SO42-、NH4+、A13+、CH3CHO |
| C.加入A1能放出H2的溶液中:Cl—、SO32-、NO3-、HCO3- |
D.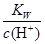 =0.1mol/L的溶液:Na+、K+、SiO32-、A1O2- =0.1mol/L的溶液:Na+、K+、SiO32-、A1O2- |
二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
| A.S2C12的结构式为Cl—S—S—Cl |
| B.反应中SO2是还原产物,S是氧化产物 |
| C.S2C12为含有极性键和非极性键的分子 |
| D.反应中,生成1molSO2,转移电子为3mol |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价) 和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示,下列说法正确的是( )
| A.电池放电时,Na+从b极区移向a极区 |
| B.电极a采用MnO2,放电时它被还原 |
| C.该电池负极的电极反应式为:BH4-+8OH––8e– = BO2-+6H2O |
| D.放电时,a极区溶液的pH升高,b极区溶液pH降低 |
已知Br2+2Fe2+=2Fe3++2 Br –,当向含1mol FeBr2溶液中逐渐通入Cl2,溶液中有一半的Br –被氧化时,下列判断不正确的是( )
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl - )="c(Br" -) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++2 Br –+2Cl2=2Fe3++Br2+4Cl– |