(10分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1).该反应的平衡常数表达式K= 。
(2).830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3).1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
某无色溶液,由Na+、Ag+、Ba2+、Al3+、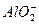 、
、 、
、 、
、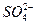 中的若干种组成,取该溶液进行如下实验:
中的若干种组成,取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验完成下列问题:
(1)溶液中一定不存在的离子是_____________________________________________。
(2)一定存在的离子是__________________________________。
(3)判断沉淀乙成分的方法是____________________________。
在HCHO分子中,四个原子处在同一平面上,C原子采用的杂化是()
| A.sp | B.sp2 | C.sp3 | D.其他杂化形式 |
六价铬对人体有毒,含铬废水要经过化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中六价铬还原成三价铬离子,再加入过量的石灰水,使铬离子生成Cr(OH)3沉淀。
(1)配平下列主要反应的化学方程式。 H2Cr2O7+
H2Cr2O7+ FeSO4+
FeSO4+ H2SO4——
H2SO4—— Fe2(SO4)3+
Fe2(SO4)3+ Cr2(SO4)3+
Cr2(SO4)3+ H2O
H2O
(2)处理后的沉淀中有Cr(OH)3外,还有__________________ (用化学式表示)。
(3)现在处理1×103 L含铬(+6)78 mg·L-1的废水,需要绿矾_________ g。
根据下列几种物质的熔点和沸点数据,判断下列有关说法中错误的是()
| NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质硼 |
|
| 熔点/℃ |
801 |
710 |
190 |
—68 |
2 300 |
| 沸点/℃ |
1 465 |
1 418 |
182.7 |
57 |
2 500 |
| A.SiCl4是分子晶体 | B.单质硼是原子晶体 |
| C.A1C13加热能升华 | D.MgCl2所含离子键的强度比NaCl大 |
古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的SO42-还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
①写出该电化腐蚀的正极反应的电极反应式:
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)