下列反应的离子方程式正确的是
| A.碳酸钙溶于盐酸:CO32- + 2H+=H2O +CO2↑ |
| B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C.KOH溶液与KHSO4溶液反应:OH-+H+=H2O |
| D.Ba(OH)2和(NH4)2SO4溶液混合加热:Ba2++ SO42-=" Ba" SO4↓ |
对于0.1 mol·L-1 NH4Cl溶液,下列说法或列式正确的是
| A.升高温度,溶液pH升高 |
| B.c(NH4+) + c(OH-)=c(Cl-)+ c(H+) |
| C.通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| D.c(Cl-) > c(H+) > c(NH4+) > c(OH-) |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)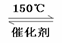 2N2(g)+3H2O(g)
2N2(g)+3H2O(g) H<0,在恒容的密闭容器中,下列有关说法正确的是
H<0,在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的速率加快,平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
下列各组离子在指定溶液中能大量共存的是
| A.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
| B.由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C.有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3- |
| D.酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl- |
在t℃下,某反应达到平衡,平衡常数K=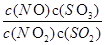 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是
| A.升高温度,逆反应速率减小 |
B.该反应化学方程式为:NO+SO3 NO2+SO2 NO2+SO2 |
| C.该反应的焓变为正值 |
| D.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)="2HCl(g)" ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1-ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1+2ΔH2 |