试判断用于汽车净化的一个反应2NO(g)+2CO(g)=N2(g)+2CO2(g)在298K、100kPa下能否自发进行?
已知:在298K、100kPa下该反应的△H=-113.0kJ·mol-1,
△S=-145.3 J·mol-1·K-1
(届广东省华附、省实、深中、广雅高三四校联考理综化学试卷)
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是(填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象。

(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体,(填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是。
A.装置I的气球体积较大 B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
| 实验方案 |
预测现象 |
预测依据 |
实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色 沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 |
有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色 沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1:;实验2:。
(届安徽省濉溪县高三第三次月考化学试卷)
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
【实验】在0.1 mol∙L-1 MgSO4、0.05 mol∙L-1Al2(SO4)3的混合溶液中滴加0.5 mol∙L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:;
推测3:。
若推测1符合实际情况,则a点之前反应的离子方程式为,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 |
检验方法 |
美国化学家R.F.Heck因发现Heck反应而获得2010年诺贝尔化学奖。例如经由Heck反应合成一种防晒剂:
反应①: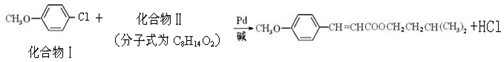
化合物Ⅱ可由以下合成路线获得: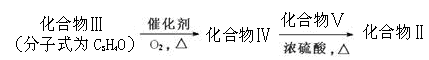
(1)化合物I核磁共振氢谱显示存在 组峰,化合物I的分子式为 。
(2)1mol化合物Ⅱ完全燃烧最少需要消耗 mol O2,其完全水解的化学方程式为 (注明条件)。
(3)化合物Ⅲ中含氧官能团的名称是 ;化合物Ⅴ与浓H2SO4共热生成化合物Ⅵ,化合物Ⅵ能使酸性KMnO4溶液褪色,化合物Ⅵ的结构简式是 。
(4)化合物Ⅰ的一种同分异构体化合物Ⅶ符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。化合物Ⅶ与过量NaOH溶液共热,发生反应的方程式为 。
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知: R1-CH=CH-R2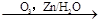 R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)A分子中若有一个氢原子被溴原子取代,则取代产物有种。F的名称是,C中含有的官能团的名称是。
(2)③的反应条件是。
(3)写出下列反应类型:⑥,⑨。
(4)有机物B和I的关系为(填序号,多填扣分)。
| A.同系物 | B.同分异构体 | C.都属于醇类 | D.都属于烃 |
(5)写出反应⑩的化学方程式:。
柠檬醛是一种用于合成香料的工业原料。经分析测定柠檬醛分子结构呈链状,碳原子的排列方式可以划分为若干个异戊二烯(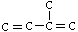 )分子的碳链结构,相对分子质量为152。
)分子的碳链结构,相对分子质量为152。
现取1 mol柠檬醛在氧气中充分燃烧,产物为CO2和H2O,且生成CO2的物质的量比H2O多2 mol。
试填写下列空白:
(1)柠檬醛的分子式为,结构简式为。
(2)设计一实验,证明柠檬醛分子结构中含有醛基(简要说明所用的试剂、实验步骤、实现现象和结论)。
。
(3)已知溴水能氧化醛基,若要检验其中的碳碳双键,其实验方法是。
(4)柠檬醛分子有多种同分异构体,请写出属于醇类、分子结构中不含甲基和不饱和碳原子的任意一种同分异构体的结构简式。