实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
| A.所有的放热反应都是自发进行的 |
| B.所有的自发反应都是放热的 |
| C.焓变是影响反应是否具有自发性的一种重要因素 |
| D.焓变是决定反应是否具有自发性的唯一判据 |
在2A+B  3C+4D反应中,表示该反应速率最快的是:
3C+4D反应中,表示该反应速率最快的是:
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
在一密闭容 器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)
器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)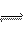 5C(g) 反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时
5C(g) 反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时
B的转化率为:
| A.40% | B.50% | C.60% | D.70% |
在相同条件下,下列物质分别与H2反应,当消耗等物质的量的H2时放出热量最多的是
| A.Cl2 | B.Br2 | C.I2 | D.S |
已知热化学方程式:SO2(g)+ O2(g)  SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.196.64kJ/mol |
| C.<196.64kJ | D.>196.64kJ |
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) ="=" 2H2O(1) △H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1) △H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g) △H= ―571.6 kJ/mol |
| D.H2(g)+O2(g) ="=" H2O(1) △H= ―285.8kJ/mol |