自热米饭是一种快餐食品。
⑴图中菜肴包的包装材料是铝箔。铝可以压制成铝箔,说明铝具有良好的 性。
⑵铝在空气中具有很好的抗腐蚀性能的主要原因是( )。
| A.铝不会与空气中的氧气反应 | B.铝的化学性质很稳定 |
| C.铝表面的氧化膜具有保护作用 | D.铝不与酸发生反应 |
⑶加热原理是利用发热包中生石灰(CaO)与水反应生成熟石灰[Ca(OH)2]放出热量进行加热,生石灰与水反应的化学方程式为 ;其基本反应类型是
写出下列反应的文字表达式或符号表达式,并回答有关问题:
⑴硫在空气中燃烧,火焰的颜色;
⑵铁丝在氧气中燃烧 ,
集气瓶底部放少量水或铺一层细沙的原因:;
⑶氯酸钾和二氧化锰共热制取氧气;
⑷石蜡在空气中燃烧;
上述反应中属于化合反应,又属于氧化反应的是,属于分解反应的是。
现有①液氧、②过氧化氢溶液、③铁、④二氧化碳、⑤氧化镁、⑥蒸馏水、⑦加热高锰酸钾完全反应后的剩余固体、⑧液态空气、⑨氯酸钾九种物质,其中属于混合物的是
(填序号下同);属于氧化物的是;属于含氧元素的化合物,但不属于氧化物的是;含有氧分子的是.
在H2O、H、H2、O、H+、O2、O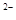 七种微粒中,属于分子的是;属于原子的是;属于离子的是.H和H+两种微粒相同的是
七种微粒中,属于分子的是;属于原子的是;属于离子的是.H和H+两种微粒相同的是
,不同的是.
现有“氧气、二氧化碳、氢气、氮气、稀有气体、明矾、活性炭” 等物质,填写下列空格:
⑴为防止膨化食品易碎和延长保质期而充入包装袋中的是;
⑵炼钢用的氧化剂的是;
⑶充入灯泡中可以产生不同颜色的光的是;
⑷可作为高能清洁燃料的是;
⑸净化水时可作絮凝剂的是。
用适当的符号填空:
⑴2个氮原子;
⑵硝酸根离子;
⑶硫酸铜;
⑷氧化铝中铝元素的化合价;
⑸构成氯化钠的粒子;
⑹保持水的化学性质的最小粒子。