漂白粉在溶液中存在下列平衡:ClO- + H2O 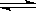 HClO + OH-,下列措施能提高漂白效果的是( )
HClO + OH-,下列措施能提高漂白效果的是( )
| A.加水稀释 | B.加入适量NaOH | C.通入少量SO2 | D.加入适量盐酸 |
下列实验操作中正确的是
| A.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 |
| B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C.蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
a g NH3含b个氢原子,则阿伏加德罗常数可表示为
A. |
B.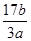 |
C. |
D. |
中国食盐产量居世界首位。下列实验室中的操作类似“海水煮盐”原理的
| A.蒸馏 | B.蒸发 | C.过滤 | D.搅拌 |
下列行为符合安全要求的是
| A.进入煤矿井时,用火把照明 |
| B.节日期间,在开阔的广场燃放烟花爆竹 |
| C.用点燃的火柴在液化气钢罐瓶口检验是否漏气 |
| D.实验时,将水倒入浓硫酸配制稀硫酸 |
甲、乙两烧杯中分别盛有100mL 3mol/L的硫酸和NaOH溶液,向两烧杯中各加入等质量的铝粉,反应结束后测得生成的气体体积比为甲︰乙=2︰3,则加入铝粉的质量为
| A.5.4g | B.7.2g | C.8.1g | D.10.8g |