在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
| A.a<b | B.平衡向逆反应方向移动了 |
| C.平衡向正反应方向移动了 | D.物质B的质量分数增加了 |
工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g) ΔH=+Q KJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是( )
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ |
| C.将反应的温度由T1升高至T2,则对应温度下的平衡常数K1> K2 |
| D.当反应吸收热量为0.25 Q kJ时,生成的HCl恰好与1 mol NaOH反应 |
25℃、101kPa下,4g CH4完全燃烧生成CO2和液态水时,放出222.5 kJ的热量,则下列热化学方程式中正确的是( )
| A.CH4(g)+2O2(g)=CO2(g)+2 H2O(g ) △H=-890kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2 H2O(l ) △H=+890kJ/mol |
C. CH4(g)+O2(g)= CH4(g)+O2(g)=  CO2(g)+H2O(1) △H=-445kJ/mol CO2(g)+H2O(1) △H=-445kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2 H2O(l ) △H=-890kJ |
对于可逆反应:2A(g)+B(g) 2C(g) △H <0,下列各图中正确的是( )
2C(g) △H <0,下列各图中正确的是( )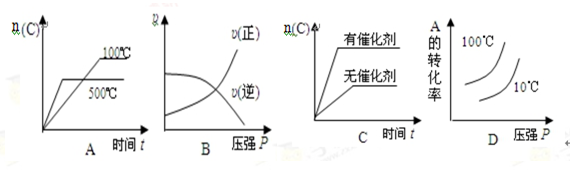
化学反应A2(g)+B2(g)= 2AB(g)的能量变化如图所示,下列有关叙述中正确的是( )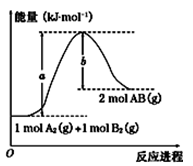
| A.每生成2 mol AB(g)共吸收b kJ能量 |
| B.该反应热ΔH=+(a-b)KJ·mol-1 |
| C.反应物的总能量大于生成物的总能量 |
| D.断裂1 mol A—A键,放出a kJ能量 |
2L密闭容器中,反应2SO2(g)+O2(g) 2SO3(g),经一段时间后SO3的物质的量增加了0.8 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·min -1,则这段时间为( )
2SO3(g),经一段时间后SO3的物质的量增加了0.8 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·min -1,则这段时间为( )
| A.0.5s | B.1s | C.30s | D.60s |