现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是( )
| A.加水稀释成100 mL |
| B.加入10 mL的水进行稀释 |
| C.加入10 mL 0.01 mol/L的NaOH溶液 |
| D.加入10 mL 0.01 mol/L的HCl溶液 |
室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是
| A.水电离出的H+的浓度是1.0×10-4 mol·L-1 |
| B.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3) |
| C.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
Li-Al/FeS电池是一种正在开发的电动车用电池,该电池反应式为:
2Al+6Li++3FeS=2Al3++3Li2S+3Fe。有关该电池的下列说法中,正确的是
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li-Al在电池中作为负极材料,负极的电极反应式为Li-e-=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
下列实验操作与预期实验目的或所得实验结论正确的是
| 编号 |
实验操作 |
实验目的或结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中不一定含有SO42- |
| B |
用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色 |
该溶液中一定含有Na+,无k+ |
| C |
将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 |
CH3CH2Br未发生水解 |
| D |
将打磨过的Al片投到一定浓度的CuCl2溶液,出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 |
Al与CuCl2溶液反应,生成了H2和Cu(OH)2 |
洋蓟素是一种新 结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是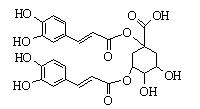
| A.1mol洋蓟素最多可与6mol Br2反应 |
| B.结构中有2个手性碳原子 |
| C.一定条件下能发生酯化反应和消去反应 |
D.1mol洋蓟素最多可与9mol N aOH反应 aOH反应 |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B.2SO2(g) + O2(g)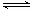 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示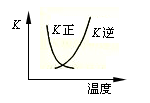 |
C.2NO+2CO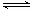 2CO2+N2的△H<0,则该反应一定能自发进行 2CO2+N2的△H<0,则该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 |