有一合金由X、Y、Z、W四种金属组成 ①若将合金放入盐酸中只有Z、Y能溶解②若将合金置于潮湿空气中,表面只出现Z的化合物③若将该合金作阳极,用X盐溶液作电解质溶液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( )
| A.Y>Z>W>X | B.Z>Y>W>X | C.W>Z>Y>X | D.X>Y>Z>W |
下列事实不能用勒夏特列原理解释的是
| A.打开碳酸饮料会有大量气泡冒出 |
| B.用难溶FeS固体除去工业废水中的Pb2+ |
| C.温度控制在500℃有利于合成氨反应 |
| D.实验室用排饱和食盐水的方法收集氯气 |
用物质的量均是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是
| A.c(CH3COOH)>c(CH3COO-) |
| B.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| C.c(H+)>c(OH-) |
| D.c(CH3COO-)+c(OH-)=0.1mol·L-1 |
向三份0.1 mol·L-1Na2CO3溶液中分别加入少量NH4N O3固体、NaHCO3固体、HCl气体(忽略溶液体积变化),则CO32-浓度的变化依次为
O3固体、NaHCO3固体、HCl气体(忽略溶液体积变化),则CO32-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g) 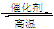 CO2+H2,当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2,当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
| A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 |
| B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
| C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
| D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
某学生用碱式滴定管量取0.1mol/L的NaOH溶液,开始时仰视液面,读数为11.00mL,取出部分溶液后,俯视液面,读数为19.00mL,实际取出液体的体积是
| A.大于8.00mL | B.小于8.00mL | C.等于8.00mL | D.无法确定 |