甲乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)若采用18mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__ 。
③定容的正确操作是
④下列操作会使配得的溶液浓度偏小的是( )
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 |
| D.胶头滴管加水时,有少量水滴到容量瓶外 |
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处
(1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00 mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如下图所示。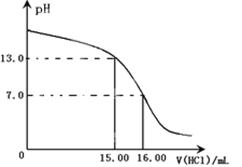
实验过程中需要使用的仪器有铁架台、滴定管夹、、、________、,由图可计算出标准HCl溶液的物质的量浓度为___________(忽略溶液混合时的体积变化)。
(2)该小组同学在探究上述NaOH溶液与酚酞溶液作用时,发现了一个意外现象:向少量酚酞溶液中滴加NaOH溶液,开始时溶液变红色,但继续滴加NaOH溶液至一定量时红色消失。对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计。
甲:可能是NaOH溶液与空气中的CO2反应造成的。
乙:可能是溶液在碱性条件下继续与空气中的氧气反应造成的。
丙:可能与NaOH溶液的浓度有关。
【理论分析】①乙同学认为甲同学的猜想明显错误,他的理由是__________ _____。
【实验设计】②为证实乙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 |
设计此步骤的目的 |
| 将配制的NaOH溶液加热 |
|
| 在加热后的溶液中滴加酚酞,并在上方滴加一些植物油 |
③通过以上实验,三位同学看到:溶液先变成红色,一会儿红色消失。因此溶液褪色与氧气无关。若丙同学的猜想正确,请你设计一个简单的实验加以证明(按要求填写在下表中):
| 实验方案 |
观察到的现象和结论 |
(12分)某兴趣小组用下图装置探究氨的催化氧化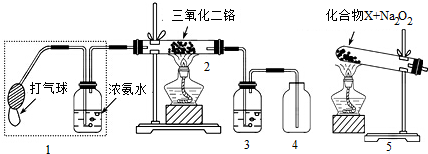
(1)氨催化氧化的化学方程式为___________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应_________热量(填“吸收”或“放出”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________。
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________。
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研 究性学习小组做了以下实验:
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为。
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是。
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有性。
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】___________
| A.加入NaOH溶液的体积为1.2L |
| B.Cu和Cu2O混合物质量为27.2g |
| C.混合物完全溶解后溶液中n(H+)=0.3mol |
| D.将等质量混合物完全还原至少需标准状况下H21.12L |
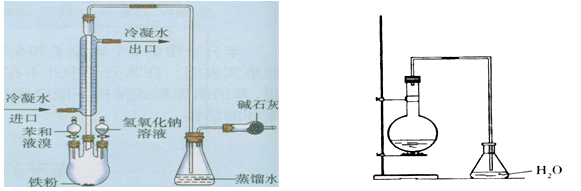
实验室用下面(右图)装置制取少量溴苯,试填写下列空白。
(1)在烧瓶a中反应的化学方程式是。
(2)长直导管b的作用:一是,二是。
(3)分析导管c的下口能不能浸没于液面中?为什么?
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有淡黄色沉淀生成,
此现象说明这种获得溴苯的反应属于(填有机反应类型)。
(5)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体生成,这可能是因为的缘故。获得纯净的溴苯所用的主要试剂是。纯溴苯为色液体,它的密度比水(轻或重)。将溴苯和苯的混合物分离的操作是。
(6)采用(左图)装置进行实验,比较两个实验,请指出(左图)的两个优点
、。
(18分)某实验探究小组为了验证红热的炭与浓硫酸发生反应所生成的各种产物,设计了一个实验流程,其装置图如下。
(1)①中反应的化学方程式为。
(2)②处的现象是。
(3)品红溶液使用了两次,③的作用是,
⑤的作用是。
(4)④的作用是;反应的化学方程式为。
(5)根据现象可证明产物中一定有CO2气体。
(6)同学甲认为撤去装置⑤也可以确定CO2的存在,他所根据的实验现象是。
(7)同学乙认为④中的溶液挥发出有毒的Br2蒸气,建议换成另外一种中学常见的有色溶液更安全,这种溶液是。