甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1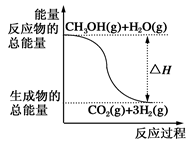
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
可用于检验乙醇中是否含有水的试剂是()
| A.无水硫酸铜 | B.生石灰 | C.金属钠 | D.浓硫酸 |
下列说法正确的是()
| A.石油分馏塔从上到下的分馏产品依次是石油气、汽油、煤油、润滑油、柴油、重油 |
| B.石油的各种分馏产品具有固定的沸点 |
| C.石油裂化的目的是提高汽油等轻质油的产量和质量 |
| D.石油裂解的主要目的是得到甲烷、丙烷等气态烷烃 |
下列燃料中,不属于化石燃料的是 ( )
| A.汽油 | B.煤 | C.氢气 | D.天然气 |
下列叙述正确的是
| A.在常温、常压下,燃烧1mol乙烯消耗的氧气比燃烧1mol乙醇消耗的氧气多 |
| B.在常温、常压下,异戊烷比戊烷熔点高 |
| C.乙烯不存在同分异构体 |
| D.红磷和白磷属于同分异构体 |
下列各化合物中能发生酯化反应,且显酸性的是
| A.CH2=CH—CH2OH | B.HO—CH2—CH2—CH2—COOH |
| C.HNO3 | D.乙醇 |