下列离子方程式书写正确的是
| A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
| B.稀盐酸与小苏打溶液混合:CO32-+2H+=CO2↑+H2O |
| C.鸡蛋壳溶于食醋:CaCO3+2H+=Ca2++CO2↑+H2O |
| D.AlCl3溶液加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
设NA为阿伏伽德罗常数,下列叙述正确的是()
| A.标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA |
| B.0.1molNa2O2晶体中含有0.3NA个离子 |
| C.pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
两种气态烃组成的混合物0.1 mol 完全燃烧得0.16 molCO2和3.6g水。下列说法的是
| A.一定有甲烷 | B.一定有甲烷和乙烯 | C.一定有乙烷 | D.一定有乙烯 |
下列各组有机物只用一种试剂无法鉴别的是
| A.乙醇、甲苯、硝基苯 | B.四氯化碳、己烷、己烯 |
| C.苯、甲苯、环己烷 | D.苯、乙醇、乙酸 |
下列化合物跟溴和铁粉反应,氢原子被取代,所得一溴代物C8H9Br有二种同分异构体的是
A. |
B. |
C.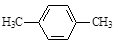 |
D. |
对氟里昂的有关叙述正确的是()
| A.有两种同分异构体 | B.是平面型分子 |
| C.是一种温室气体 | D.在高空可破坏臭氧层 |