下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇(CH3CH218OH)、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了作吸水剂的作用外还有
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 (选填 “甲”或 “乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是 
[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mLCH3CH218OH,2mL冰醋酸,并在摇动下缓缓加入2mL浓硫酸充分摇匀, (2)将试管固定在铁架上;(3)在试管②中加人适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。
[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:
无色油状液体、 ;
b.试管 ② 中饱和 Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有 的作用
c. 从试管②中分离出乙酸乙酯的实验操作是
d. 生成乙酸乙酯的化学反应方程式
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2),并将Cl2依次通入NaBr溶液和KI-淀粉溶液中。如图所示仪器及药品,试回答: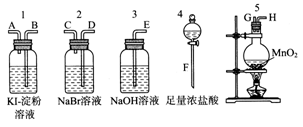
(1)若所制取气体从左向右流向时,上述仪器接口的连接顺序为________接________、________接________、________接________、________接________。(填字母)
(2)实验开始后装置5中反应的离子方程式为______________________________。
(3)装置3的作用是__________________________________,反应的离子方程式为_______________________________。
(4)装置1中产生的现象是:溶液先变蓝一段时间后蓝色褪去,生成两种强酸,请写出蓝色褪去的化学方程式:___________________________________________________。
某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为和;
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有;
(3)他们首先用下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是
(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是;
(5)通过上述探究实验,你能得到的结论是
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验.先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应
请你回答下列问题
(1)写出甲同学实验中两个主要的化学方程式、。
(2)甲同学设计的实验(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是 ___________(填字母)
| A.使溴水褪色的反应,未必是加成反应 | B.使溴水褪色的反应,就是加成反应 |
| C.使溴水褪色的物质,未必是乙炔 | D.使溴水褪色的物质,就是乙炔 |
(3)乙同学推测此乙炔中必定含有的一种杂质气体是,它与溴水反应的化学方程式是;在验证过程中必须全部除去。
(4)为验证这一反应是加成而不是取代,丙同学提出
可用pH试纸来测试反应后溶液的酸性,理由是
生活中有很多现象都蕴藏着化学秘密,如果你是一个细心的人,就一定会发现很多有趣的事。
(1)煤气灯曾是十八世纪的主要照明工具,但有一个奇怪的事引起了不少人的注意,那就是在有些煤气灯的附近,树叶比其他树要早落好长时间,但这个问题一直到1901年才由俄国的植物学家奈刘波夫证实是煤气灯产生的一种气体在作怪,你认为这种气体可能是________。(填物质名称)
(2)为了证明你的判断,下列是一位同学做的实验及其装置:
如果实验时无水硫酸铜变蓝色,澄清的石灰水变浑浊;你认为通过以上实验可以得出的结论是________________________________________________。
(3)若要进一步得出该分子的组成,另一个同学设计的实验及其装置: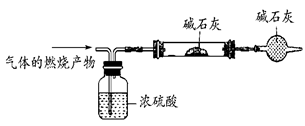
要达到实验的目的,需要下列哪些数据________(填编号)。
①此气体的质量 ②浓硫酸的增重 ③硬质玻璃管的增重
④干燥管的增重 ⑤此气体的体积(标准状况下)
(4)将这种气体在高温高压条件下与苯甲醛按一定比例混合,结果发现苯甲醛的质量和性质都没有发生变化,且还得到了一种白色固体。试推测苯甲醛的作用是________。得到的白色固体是________,发生的反应是___________(填反应类型)。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反
应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;应该测定的实验数据是____________________________。
(3)在使用铁与稀硫酸反应制氢气时,实验室里选择粗铁比纯铁效果更好,原因是:。