在下列各溶液中,离子一定能大量共存的是( )
| A.强碱性溶液中:K+、Al3+、Cl-、SO42— |
| B.含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3— |
| C.含有0.1 mol·L-1Ca2+的溶液中:Na+、K+、CO32—、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42— |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:
A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不再变化时②容器内气体的压强不再变化时
③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时
⑤混合气体的平均相对分子质量不再改变的状态 ⑥当V正(B) = 2V逆(C)
A.①④⑤⑥B.②③⑥C.②④⑤⑥D.只有④
下列排列顺序正确的是
①第一电离能Na<Al<Mg ②热稳定性:H2O>HF>NH3
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力OH﹣>CH3COO﹣>Cl﹣
⑤还原性:HF<HCl<HBr<HI ⑥离子半径:Ca2+<K+<Cl-<S2-
| A.①②③④ | B.①④⑤⑥ | C.②③④⑤ | D.③④⑤⑥ |
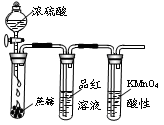
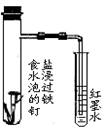
完成下列实验所选择的装置或仪器(夹持装置已略去)不正确的是
| A |
B |
C |
D |
|
| 实 验 |
证明浓硫酸有脱水性、强氧化性及SO2有还原性、漂白性 |
用于制取纯净的氢氧化亚铁 |
用于分离NH4Cl和I2的混合物 |
用于证明铁的吸氧腐蚀 |
| 装 置 或 仪 器 |
 |
 |
 |
 |
下列反应的离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
| B.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| C.Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
在下列溶液中,各组离子一定能大量共存的是
| A.PH>7的溶液中:K+、AlO2-、Cl-、SO42- |
| B.含有0.1mol/L Fe3+的溶液中:K+、Mg2+、I-、SCN-、HCO3- |
| C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D.在由水电离产生c(H+)=1×10-13mol/L的溶液中:Na+、S2O32-、 Fe3+、NO3- |