对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO2 | D.降低体系温度 |
下列叙述正确的是()
| A.氢氧化钡晶体与氯化铵晶体的反应是放热反应 |
| B.煤、石油、天然气等是化石燃料 |
| C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好 |
| D.反应物的总能量高于生成物的总能量时,发生吸热反应 |
常温下,向10mL0.1mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如图所示。下列说法正确的是()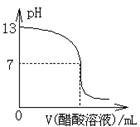
| A.pH=7时,所加醋酸溶液的体积为10mL |
| B.pH<7时,溶液中c(CH3COO-)>c(Na+) |
| C.7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.继续滴加0.1mol·L-1醋酸溶液,溶液pH可以变为1 |
右图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)  N2O4(g);△H<0。则以下说法不正确的是()
N2O4(g);△H<0。则以下说法不正确的是()
A.保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B.打开K一会,再关闭它,向右推动活塞时,最后A容器的气体颜色比B的浅
C.打开K一会,再关闭它,把A容器加热,活塞不移动,A中气体颜色比B中深
D.打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
室温下,将1.000mol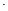
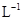 盐酸滴入20.00mL 1.000mol
盐酸滴入20.00mL 1.000mol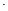
 氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是()
氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是() 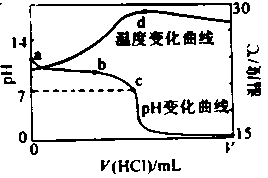
A.a点由水电离出的c(H+)=1.0 10-14mol·L-1 10-14mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
下列溶液中微粒的物质的量浓度关系正确的是()
| A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1 mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C.Na2CO3溶液: c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液: |
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)