在一定条件下进行如下反应:aX(g)+bY(g) cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填”增大”“减小”或”不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |
(2)如图所示,相同温度下,在甲、乙两容器中各投入1 mol X、2 mol Y和适量催化剂,甲、乙两容器的初始体积均为1 L。甲、乙容器达到平衡所用时间:甲 乙(填”>““<“或”=“,下同),平衡时X和Y的转化率:甲 乙。
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )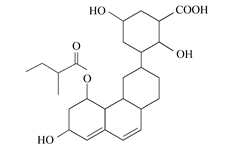
| A.能与FeCl3溶液发生显色反应 |
| B.能使酸性KMnO4溶液褪色 |
| C.能发生加成、取代、消去反应 |
| D.1 mol该物质最多可与1 mol NaOH反应 |
如图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图。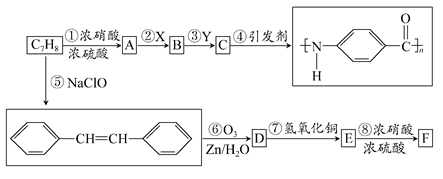
已知:Ⅰ.当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对或间位的氢原子。使新取代基进入它的邻、对位的取代基有—CH3、—NH2等;使新取代基进入它的间位的取代基有—COOH、—NO2等;
Ⅱ.RCHCHR′ 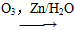 RCHO+R′—CHO;
RCHO+R′—CHO;
Ⅲ.氨基(—NH2)易被氧化;硝基(—NO2)可被Fe和盐酸还原成氨基(—NH2)。
回答下列问题:
(1)X、Y各是下列选项中的某一项,其中X为________(填序号)。
A.Fe和盐酸 B.酸性KMnO4溶液
C.NaOH溶液
(2)已知B和F互为同分异构体,写出物质F的结构简式__________________。
(3)分别写出D、E中的含氧官能团的名称________、________。
(4)对物质C的下列说法中,正确的是________(填序号)。
A.能发生酯化反应 B.能与溴水发生加成反应
C.只能和碱反应,不能和酸反应
(5)写出反应⑦的化学方程式,并注明反应类型。
________________________________________________。
下面是含有苯环的一系列化合物:
(1)B的化学名称为________,D的分子式为________,上述一系列化合物的分子通式为________。
(2)C的一氯取代物有________种。
(3)上述物质中的某一种可用于制取TNT,该反应的化学方程式为______________________________________________________。
(4)B是制备高分子化合物P的中间产物,下列为工业上制取P的简单流程:
①已知X蒸气的密度是相同条件下甲烷密度的6.5倍,则X的分子式为________。
②上述流程中反应a、b、c的反应类型分别为________、________、________。
③转化X―→P的化学方程式为__________________________________。
在烷烃分子中的基团:—CH3、—CH2—、 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。例如
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。例如 分子中,n1=6,n2=1,n3=2,n4=1。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
分子中,n1=6,n2=1,n3=2,n4=1。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子个数为n0,n0与n1、n2、n3、n4的关系是n0=________或n0=________。
(2)四种碳原子数之间的关系为________。
(3)若某分子中n2=n3=n4=1,写出该分子的可能的结构简式:________。
玫瑰的香味物质中包含苧烯,苧烯的键线式为: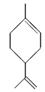
(1)1 mol苧烯最多可以跟________mol H2发生反应。
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构______________(用键线式表示)。
(3)有机物A是苧烯的同分异构体,分子中含有“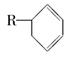 ”结构,A可能的结构为____________(用键线式表示)。
”结构,A可能的结构为____________(用键线式表示)。
(4)写出 和Cl2发生1,4加成反应的化学方程式_____________。
和Cl2发生1,4加成反应的化学方程式_____________。