制备硅单质时,化学反应如下:(1)SiO2+2C====Si+2CO↑ (2)Si+2Cl2 ===SiCl4(3)SiCl4+2H2 ===Si+4HCl。下列对上述三个反应的叙述中,不正确的是:( )
| A.(1)(3)为置换反应 | B.(1)(2)(3)均为氧化还原反应 |
| C.(2)为化合反应 | D.三个反应的反应物中硅元素均被还原 |
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是
| A.Zn和浓H2SO4 | B.C和浓HNO3 |
| C.Cu和浓HNO3 | D.Na2O2和NH4Cl浓溶液 |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
| 序号 |
甲 |
乙 |
丙 |
| ① |
CO2 |
SO2 |
澄清石灰水 |
| ② |
HCl |
CO2 |
Ba(OH)2 |
| ③ |
CO2 |
SO2 |
Ba(NO3)2 |
| ④ |
NO2 |
SO2 |
BaCl2 |
| ⑤ |
CO2 |
NH3 |
CaCl2 |
A.①②③④ B.②③④⑤ C.②③④ D.①③④
下列说法正确的是
| A.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:NO3—被还原为NO2 |
| B.SO2能使加了酚酞的NaOH溶液褪色,加热,溶液立即再变红色 |
| C.通过摇晃试剂瓶可区分浓硫酸和稀硫酸 |
| D.浓硝酸有强氧化性,常温下能与Fe发生反应 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R<W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
红热的木炭与浓HNO3反应产生的气体经如下处理:
气体产物 气体Ⅰx mL
气体Ⅰx mL 气体Ⅱy mL(在无氧环境下操作)假设气体体积均在相同状况下测定,不考虑气体的溶解,则x和y的关系是
气体Ⅱy mL(在无氧环境下操作)假设气体体积均在相同状况下测定,不考虑气体的溶解,则x和y的关系是
A.x= y y |
B.y= x x |
C.x=y | D.y=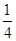 x x |