(1)下列物质:①H2O ②铜 ③小苏打 ④稀硫酸 ⑤CH3COOH ⑥酒精 属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 (用编号填写)。
(2)在下列的空白处填写最适宜的除杂试剂或方法
①小苏打溶液中含少量苏打___________,
②苏打固体中含少量小苏打___________,
③Cl2气体中混有少量的HCl气体_____________________。
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
(1)A的结构简式为____________,B中决定性质的重要官能团的名称为___________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________,反应类型:____________。
②____________________________,反应类型:____________。
③___________________________,反应类型:____________。
已知2-丁烯(CH3CH=CHCH3)跟乙烯具有相似的化学性质,丁醇(CH3CH2CH2CH2OH)跟乙醇具有相似的化学性质,丁酸(CH3CH2CH2COOH)跟乙酸具有相似的化学性质。试写出下列反应的化学方程式:
(1) 2-丁烯+溴水:_____________________________________________。
(2) 丁醇+钠:____________________________________________,
(3) 丁醇的催化氧化:_____________________________________________。
(4) 丁酸+NaOH:___________________________________。
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是 mol,燃烧产物的平均摩尔质量是 g/mol。
在①CH2=CH2②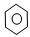 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;
现有A、B、C三种烃,其球棍模型如下图: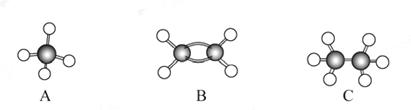
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____。