下列说法正确的是( )
| A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色 |
| B.欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶 |
| C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
| D.实验室用MnO2和稀HCl加热法制取Cl2,若有14.6 gHCl参加反应,则可制得7.1 g Cl2 |
工业上制造金刚砂(SiC)的反应的化学方程式为SiO2+3C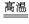 SiC+2CO↑,在这个氧化还原反应中,氧化剂与还原剂的物质的量之比是( )
SiC+2CO↑,在这个氧化还原反应中,氧化剂与还原剂的物质的量之比是( )
A.1∶2 B.2∶1
C.1∶1 D.3∶5
下列盐溶液中,加入BaCl2溶液生成白色沉淀,再加入稀HNO3振荡,白色沉淀不消失的是( )
| A.Na2SO3 | B.K2CO3 |
| C.Na3PO4 | D.Na2SiO3 |
下列叙述正确的是( )
| A.酸均不能与酸性氧化物反应 |
| B.玻璃、陶瓷、水泥容器都不能贮存氢氟酸 |
| C.石灰抹墙、水泥砌墙过程的硬化原理相同 |
| D.石灰窑、玻璃熔炉出来的气体的主要成分不相同 |
SiO2跟C有下面两个反应:
SiO2+2C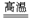 Si+2CO↑,SiO2+3C
Si+2CO↑,SiO2+3C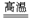 SiC+2CO↑,当SiO2与C的物质的量之比为4∶10时,硅元素的存在形式为( )
SiC+2CO↑,当SiO2与C的物质的量之比为4∶10时,硅元素的存在形式为( )
| A.Si | B.SiC | C.Si和SiC | D.SiO2 |
在含amol Ca(OH)2的石灰水中,缓慢地通入bmol CO2气体,实验过程中开始白色沉淀增多,后又部分消失,如果CO2充分被吸收,则最后得到的白色沉淀质量是( )
| A.100(2a-b)g | B.100(b-a)g |
| C.100(a-b)g | D.100(2b-a)g |