碘(I)是人必须的重要微量营养元素之一。为了消灭碘缺乏症,人们必须食用“碘盐”——含规定量碘酸钾(KIO3)的食盐。请计算:
(1)碘酸钾的相对分子质量为 ;
(2)碘酸钾各种元素的质量比为 ;
(3)若要获取2.54g碘,需要碘酸钾(KIO3)多少克?
.下图是用铜粉氧化法生产氧化铜的流程图。据图回答下列问题: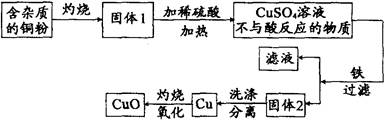
(1)铜粉灼烧后可能有氧化铜和氧化亚铜两种物质。氧化亚铜(Cu2O)中铜元素的化合价是________价。
(2)已知氧化亚铜和稀硫酸反应可生成硫酸铜和铜。假如固体1中只含有铜的氧化物,下列推理合理的是___________(填序号)。
①固体1中加入稀硫酸,若溶液呈蓝色,说明该固体中一定有氧化铜
②固体1中加入稀硫酸,若有红色沉淀物,说明该固体中一定有氧化亚铜
(3)将得到的1.6吨氧化铜全部转化为硫酸铜,可得硫酸铜多少吨?(CuO+H2SO4=CuS04+H2O)
(4)若用贴有如图标签的浓硫酸100毫升可配制溶质质量分数为49%的硫酸溶液_____克。
.在氢气还原氧化铜的实验中,向50克氧化铜粉末中通氢气,加热一段时间后,测得固体质量减少8g,求:
(1)已反应掉的氧化铜质量。(列式计算)
(2)若实验时用的氢气,是用右图标签所示的浓硫酸稀释成稀硫酸后和足量的锌粒反应制取的。取用浓硫酸50毫升,小心加入到300毫升水中稀释,稀释后硫酸溶液的溶质质量分数为 。
.科学家发现,海底可燃冰分布的范围约占海洋总面积的10%,其储量是煤、石油和天然气总和的两倍,是迄今为止发现的海底最具价值的矿产
资源。可燃冰也称为“甲烷水合物”。“置换法”是开采可燃冰设想方案之一,即将CO2注人海底的甲烷水合物储层,CO2较甲烷更易形成水合物,因而就能将甲烷水合物中的甲烷分子“挤走”,从而将其“置换”出来(原理:CH4·nH2O+CO2==CO2·nH2O+CH4)。
(1)通常情况下,CH4是一种无色、无味、难溶于水、密度比空气小的气体。用如图所示的
装置收集CH4气体时,则应让气体从(选填“a”或“b”)管通入。
(2)若上述方法能够实现,那么要制取8吨的CH4气体,理论上需CO2多少吨?
38.硫化氢(H2S)是一种具有臭鸡蛋气味的致命毒气,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性。实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeS04。
(1)在右图中,应选用图作为制取H2S的装置。
(2)收集H2S气体时,应从C装置中的导管进入,对产生尾气的处理方法
是:。
(3)实验室若制取6.8克的硫化氢气体,理论上需要多少克20%的硫酸溶液?
(10宽甸)23.为了测定某些磁铁矿中四氧化三铁的质量,甲、乙两组同学根据磁铁矿与一氧化碳反应的原理,分别利用两种方法测定了磁铁矿样品中四氧化三铁的质量分数。已知磁铁铁矿与一氧化碳反应的化学方程式如下(假设磁铁矿中的杂质不参加反应):Fe3O4+4CO  3Fe + 4CO2。(计算最终结果保留小数点后一位)
3Fe + 4CO2。(计算最终结果保留小数点后一位)
(1)甲组同学取该磁铁样品10g,与足量的一氧化碳充分反应,并将产生的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g。请你根据甲组同学的实验数据,计算出磁铁矿样品中四氧化三铁的质量分数。
(2)乙组同学取该磁铁样品10g,与足量的一氧化碳充分反应,测得反应后固体物质的质量为8g。请你根据乙组同学的实验数据,计算出磁铁矿样品中四氧化三铁的质量分数。