铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O请回答下列问题
2PbSO4+2H2O请回答下列问题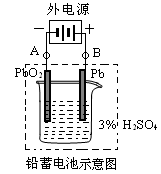
(1)放电时:正极的电极反应式是______ __ ________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量减少________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,此时铅蓄电池的正负极的极性与原来______。(“相同”或“不同”)(每空2分)
写出下列化学方程式、离子方程式或电离方程式:
(1)碳酸钠溶液和过量的醋酸溶液反应(离子方程式)
(2)镁在二氧化碳气体中燃烧(化学方程式)
(3)次氯酸电离(电离方程式)
趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第次检测结果不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子(提示:Ag2SO4微溶于水):
第一步:向溶液中滴加过量的溶液,其目的是检验CO32-。并将其除去;
第二步:加入过量的Ba(NO3)2,其目的是;
第三步:过滤,再向滤液中加入溶液(填化学式),发生反应的离子方程式。
2KMnO4+16HCl=2MnCl2+5Cl2↑+8H2O+2KCl,在这个反应中,氧化剂是,氧化产物是,用双线桥标出电子的转移方向和数目。
化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
分离墨水中的染料的方法;
用四氯化碳提取溴水中的溴单质的方法;
分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)的方法;
从含有少量氯化钠的硝酸钾溶液中提取硝酸钾的方法。
七种物质回答问题:①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸溶液 ⑤二氧化碳气体 ⑥蔗糖晶体 ⑦ 熔融氯化钠
属于电解质的是:(填编号,下同),属于非电解质的是,能导电的是。